Time:2015-12-08 13:18:34
再曝惨案:9机构被立案、596药品「自杀」

来源:赛柏蓝 作者:司徒阳明
昨天,国家食品药品监督管理总局(CFDA)发布《关于14家企业13个药品注册申请不予批准的公告》(2015年第260号) ,又有13个药品因为临床试验核查折戟药品注册。他们是:
常州制药厂有限公司申报的阿司匹林缓释片(受理号:CYHS1190075),苏州中化药品工业有限公司申报的瑞巴派特分散片(受理号:CXHS1200167),西安恩慈制药有限公司申报的头孢地尼干混悬剂(受理号:CXHS1200057)
重庆圣华曦药业股份有限公司申报的来曲唑片(受理号:CYHS1290097),深圳南方盈信制药有限公司和合肥久诺医药科技有限公司申报的依普利酮片(受理号:CXHS1400017)和依普利酮胶囊(受理号:CXHS140001)
无锡福祈制药有限公司和广东爱民药业有限公司申报的氨酚曲马多胶囊(受理号:CXHS1200035),福安药业集团庆余堂制药有限公司申报的阿戈美拉汀片(受理号:CYHS1490053)
江苏神龙药业有限公司申报的硫辛酸分散片(受理号:CXHS1400243),安徽恒星制药有限公司申报的苯磺酸左旋氨氯地平片(受理号:CYHS1290126),陕西方舟制药有限公司申报的盐酸多奈哌齐口腔崩解片(受理号:CXHS1400294)
广东彼迪药业有限公司申报的盐酸多奈哌齐分散片(受理号:CXHS1100096),华裕(无锡)制药有限公司申报的富马酸喹硫平片(受理号:CYHS1290042),共计13个药品。
因其注册申请存在临床试验数据不真实和不完整的问题,国家食品药品监督管理总局根据《药品注册管理办法》有关规定,对上述13个药品注册申请不予批准。
另有596药品撤回申请
7月22日,国家局发布通知,要对临床试验进行自查、核查,药界称之为“七二二惨案”,药监核查风暴由此而起。
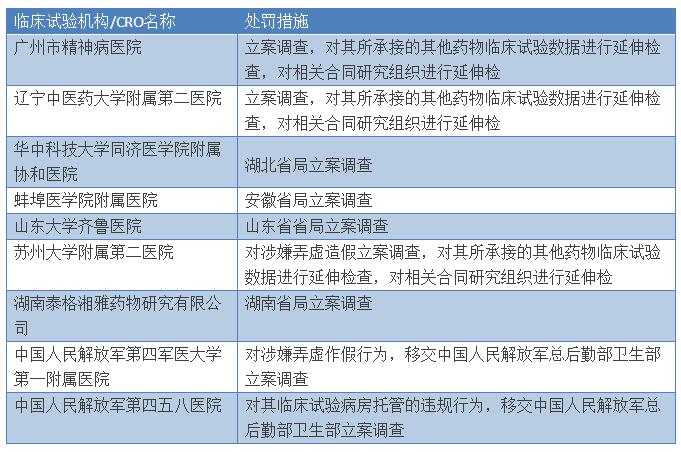
这是国家局第二次列出不予批准的公告。11月11日,国家局发表公告,2015年10月26日—31日,国家食品药品监督管理总局对部分已提交自查资料的药品注册申请进行了临床试验数据现场核查,8家企业11个药品注册申请未被批准。加上此次的13个药品的注册未被批准,共有24个药品注册申请被拒。在昨日的公告中,国家局将13个药品在注册核查中出现的问题一一列出,而且处罚同样毫不手软:
决定对苏州大学附属第二医院涉嫌弄虚造假行为予以立案调查,对其所承接的其他药物临床试验数据进行延伸检查,对相关合同研究组织进行延伸检查;
对湖南泰格湘雅药物研究有限公司由湖南省食品药品监督管理局立案调查;
对中国人民解放军第四军医大学第一附属医院药物临床试验数据涉嫌弄虚造假行为、中国人民解放军第四五八医院的临床试验病房托管的违规行为,移交中国人民解放军总后勤部卫生部立案调查。
同时,国家局还表示将在查清事实的基础上,明确注册申请人、药物临床试验机构和合同研究组织的相关人员的责任,涉及医疗机构的相关责任人由卫生计生部门处理,涉嫌犯罪的移交公安机关。
另,此次自查、核查风暴中,药监局列出了1622品种,截止日前,已经有596的品种“自杀”:主动撤回了药品注册申请,撤回率为36.74%。有药企戏言,以前药品注册时等死,现在是主动找死。
药企对造假负主体责任!
国家局临床试验核查风暴还会继续吗?毫无疑问。
据国家局官方网站的消息,12月4日,国家食品药品监管总局在京召开全国药物临床试验数据核查工作座谈会,通报了前一阶段临床试验数据自查核查工作情况,研究部署下一阶段工作。食品药品监管总局局长毕井泉,副局长吴浈、孙咸泽,食品安全总监郭文奇出席会议。
会议强调,药物临床试验是保障上市药品质量的关键环节,临床试验数据造假严重影响药品的有效性和安全性,严重影响药品科学研究和技术创新,严重影响药品审评审批效率,严重影响中国制药业的国际竞争力。下大力气整肃临床试验数据造假行为,是落实最严格监管的具体行动,是推进药品审评审批制度改革的重要内容,是维护人民群众切身利益的需要。
会议要求,各级食品药品监管部门要认真履行对临床试验数据的监管责任,督促落实申报企业保证申报资料真实性的主体责任、临床试验机构的管理责任、临床试验研究者的直接责任以及合同研究组织的相关责任。组织企业进一步开展自查,鼓励主动纠错,严惩数据造假,区别处理数据造假与不规范、不完整两类性质不同的问题。
上面的官方新闻值得注意的是,对于临床试验中,国家局对各个环节责任划分,那就是,药企负有主体责任,临床试验机构管理责任,临床试验研究者的直接责任以及合同研究组织的相关责任,可见,在国家局看来,药企们是主要责任人。
现在,国家局可能因为历史原因,对药企实际上网开一面,主动撤回了就不追责。但是,在提交新药品注册申请时,药企提交资料时一定要万分小心了,申报资料真实性主体责任在于药企,再出现资料不真实,药企可能会受到牵连了。选择CRO公司和临床试验机构一定要万分小心。
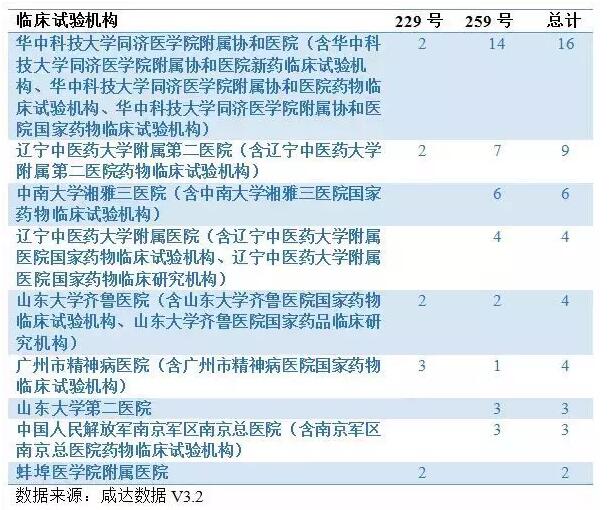
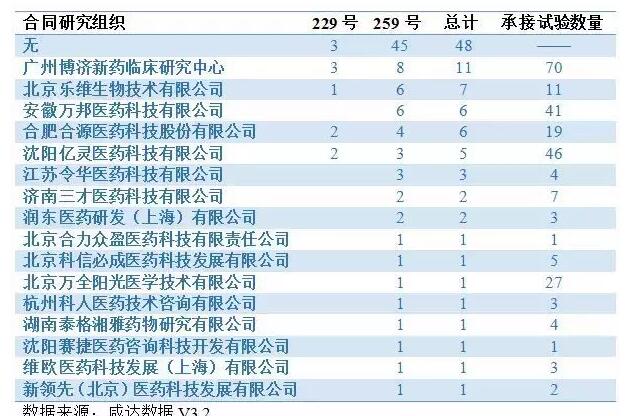
下面国家局在11月11日和12月7日的公告中被立案的临床试验机构和CRO组织的名单:
此外,根据国家局的公告,目前已经有596个药品撤回了药品注册申请,下面是微信公众号咸达数据统计的撤回药品注册申请部分临床试验机构和CRO公司的名单。